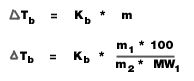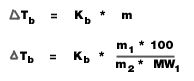สมบัติคอลลิเกตีฟของสารละลาย
สารละลายเป็นสารเนื้อเดียวที่ได้จากการผสมสารบริสุทธ์ตั้งแต่
2 ชนิดขึ้นไปเข้าด้วยกัน
ถ้าสารที่นำมาผสมกันมีสถานะเดียวกันจะถือว่าสารที่มีปริมาณมากที่สุดเป็นตัวทำละลาย
ส่วนสารที่มีปริมาณน้อยกว่าเป็นตัวละลาย
จุดเดือดของสารละลายสูงกว่าตัวทำละลายบริสุทธิ์
และจุดหลอมเหลวของสารละลายต่ำกว่าตัวทำทำละลายบริสุทธิ์
และถ้าสารละลายที่มีความเข้มข้นในหน่วยโมลต่อกิโลกรัมเท่ากัน
จะมีจุดเดือดและจุดหลอมเหลวเท่ากัน
โดยที่ตัวละลายจะเป็นสารใดก็ได้แต่ต้องเป็นสารที่ระเหยยากและไม่แตกตัวเป็นไอออน
ส่วนสารละลายที่มีความเข้มข้นต่างกัน
แม้จะมีตัวทำละละายชนิดเดียวกันก็มีค่าจุดเดือดและจุดหลอมเหลวไม่เท่ากัน
สูตรเกี่ยวกับสารละลายที่มีสมบัติคอลลิเกตีฟ
1. จุดเดือด
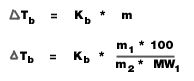
 =
จุดเดือดของสารละลาย -
จุดเดือดของตัวทำละลาย (องศาเซลเซียส)
=
จุดเดือดของสารละลาย -
จุดเดือดของตัวทำละลาย (องศาเซลเซียส)
Kb =
ค่าคงที่ของการเพิ่มขึ้นของจุดเดือดของสารละลาย
(องศาเซลเซียส/mol/kg)
m = ความเข้มข้นของสารละลาย (mol/kg)
m1 = มวลตัวถูกละลาย (g)
m2 = มวลของตัวทำละลาย (g)
MW1 = มวลโมเลกุลของตัวถูกละลาย
2. จุดหลอมเหลว
(หรือจุดเยือกแข็ง)

 =
จุดเยือกแข็งของตัวทำละลาย -
จุดเยือกแข็งของสารละลาย (องศาเซลเซียส)
=
จุดเยือกแข็งของตัวทำละลาย -
จุดเยือกแข็งของสารละลาย (องศาเซลเซียส)
Kf =
ค่าคงที่ของการลดลงของจุดเยือกแข็งของสารละลาย
(องศาเซลเซียส