สมบัติของธาตุตามตารางธาตุ
การจัดธาตุลงในตารางธาตุ

ตารางธาตุประกอบด้วยธาตุ 8 หมู่
1.ธาตุหมู่ I มีสมบัติเป็นโลหะซึ่งมีคุณสมบัติว่องไวในการผสมธาตุมาก ธาตุหมู่ I เรียกว่า alkalai metal
และมีอิเล็กตรอนวงนอกสุดอยู่ 1 ตัว
2.ธาตุหมู่ II เป็นธาตุโลหะ มีอิเล็กตรอนวงนอกสุด 2 ตัว ธาตุที่ว่องไวที่สุดในหมู่นี้ คือเรเดียม (Ra)
3.ธาตุหมู่ III จะเริ่มประกอบด้วยโลหะและอโลหะ มีอิเล็กตรอนวงนอกสุด 3 ตัว
4.ธาตุหมู่ IV มีอิเล็กตรอนวงนอกสุด 4 ตัว
5.ธาตุหมู่ V ในตอนต้น ๆ จะเป็นอโลหะ ธาตุถัดมา เช่น สารหนู (As) และอันติโนมี (Sb)
จะแสดงคุณสมบัติระหว่างโลหะและอโหดก้ำกึ่งกัน ลักษณะเช่นนี้เรียกว่ามีสมบัติเป็น metalloid
6.ธาตุหมู่ VI ตอนต้นหมู่จะมีธาตุที่มีสมบัติเป็นอโลหะ แล้วค่อย ๆ เป็นโลหะ
7.ธาตุหมู่ VII มีชื่อเรียกว่า Halogen group ธาตุหมู่นี้เป็นอโลหะ ที่ว่องไวในการผสมธาตุมาก
8.ธาตุหมู่ VIIIจัดเป็นธาตุ Inert gas จึงไม่ค่อยทำปฏิกิริยากับธาตุอื่น เพราะมีอิเล็กตรอนวงนอกสุดเท่ากับ8
หมู่ธาตุทรานซิชั่น (Transition elements ) ได้แก่
Lanthanide series ประกอบด้วยธาตุที่มี Atomic number 57 - 70 เป็นธาตุที่หายากมาก
Actinide series ประกอบด้วยธาตุที่มี Atomic number 89 - 102
ธาตุในหมู่นี้มีคุณสมบัติเป็นสารกัมมันตรังสี
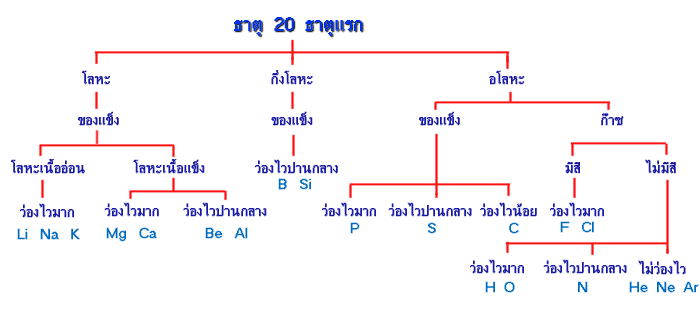
การจัดกลุ่มธาตุ 20 ธาตุแรกโดยใช้เกณฑ์ย่อย
ประวัติการค้นพบและการจัดธาตุลงในตารางธาตุ
จากความรู้ในทางฟิสิกส์ เคมี และดาราศาสตร์ พบว่าโลกนี้ประกอบด้วยธาตุต่างๆ มากกว่า 105 ชนิด
พบอยู่ตามเปลือกโลกซึ่งมีมากน้อยไม่เท่ากัน เช่น Si และ Fe เป็นธาตุที่มีอยู่ในใจกลางโลกเป็นจำนวนมาก
ค.ศ.1817 Dobereiner พบว่า ธาตุบางประเภทซึ่งประกอบไปด้วยธาตุ 3 ธาตุ ที่มีคุณสมบัติคล้ายคลึงกันและเขาพบว่าน้ำหนักอะตอมของธาตุหนึ่งจะมีค่าใกล้เคียงกับน้ำหนักอะตอมเฉลี่ยของธาตุอีกสองธาตุ เช่นในหมู่ธาตุ Cl , Br และ I จะพบว่าค่าน้ำหนักอะตอมเฉลี่ยของ Br เท่ากับ น้ำหนักอะตอม Cl + น้ำหนักอะตอม I
ในทำนองเดี่ยวกันยังมีธาตุที่มีคุณสมบัติเช่นนี้อีก 2 กลุ่ม คือ ธาตุสตรอนเตียม (Sr) แคลเซียม (Cl)
และธาตุแบเรียม (Ba) อีกกลุ่มคือ หมู่ธาตุเซเลเนียม(Se) ธาตุซัลเฟอร์ (S) และธาตุเลทูเรียมซึ่งธาตุหมู่ดังกล่าวเหล่านี้เรียกว่า Triads
ค.ศ. 1864 John A.R. Newlands ชาวอังกฤษได้เสนอการจัดธาตุต่างๆโดยเรียงตามน้ำหนักอะตอมซึ่งเรียกการจัดแบบนี้ว่า Law of Octaves
ต่อมาได้มีการค้นพบค่าอะตอมมิคนัมเบอร์ โดย Henry Gwyn Jeffeys Moseleys(ค่าของอะตอมมิคนัมเบอร์ คือ จำนวนโปรตอนที่มีอยู่ในนิวเคลียสของอะตอมของธาตุ) ซึ่งปัจจุบันก็ได้มีการจัดเรียงธาตุตามอะตอมมิคนัมเบอร์ แทนน้ำหนักอะตอม
พิจารณาจากตารางธาตุจะเห็นว่า ตารางธาตุประกอบด้วยธาตุ 8 หมู่ ซึ่งมีทั้งโลหะและอโลหะ และมี 7 คาบตรงกลางของตารางธาตุประกอบด้วย Transition elements ใน Transition elements นี้มีหมู่ธาตุLanthanide series และ Actinide series ซึ่งจัดเป็นธาตุที่หายากจึงนับได้ว่าเป็น Rare Earth Elements
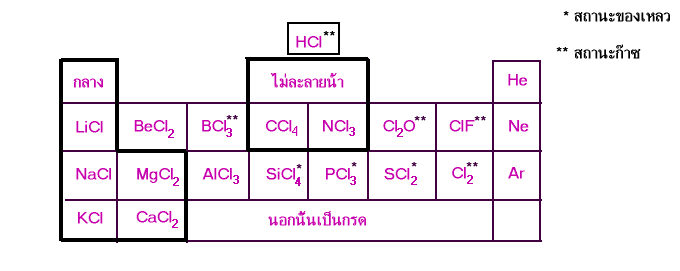
สารประกอบคลอไรด์
การเตรียมก๊าซคลอรีน
![]() 1.ปฏิกิริยาระหว่างโพแทสเซียมเปอร์แมงกาเนตกับกรดไฮโดรคลอริกเข้มข้น
1.ปฏิกิริยาระหว่างโพแทสเซียมเปอร์แมงกาเนตกับกรดไฮโดรคลอริกเข้มข้น
2.ปฏิกิริยาระหว่างโพแทสเซียมไดโครเมตกับกรดไฮโดรคลอริ
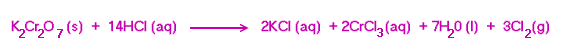
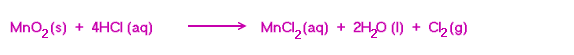
3.ปฏิกิริยาระหว่างแมงกานีส (IV) ออกไซด์ กับกรดไฮโดรคลอริก
เปรียบเทียบสารประกอบครอไรด์
สารประกอบออกไซด์
การเตรียมก๊าซออกซิเจน
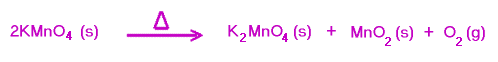
1.เผาโพแทสเซียมเปอร์แมงกาเนต
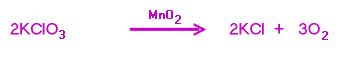
2.เผาโพแทสเซียมคลอเรต โดยมีผงแมงกานีส (IV) ออกไซด์เป็นตัวเร่งปฏิกิริยา

3.เผาโพแทสเซียมไดโครเมต
เปรียบเทียบสารประกอบออกไซด์
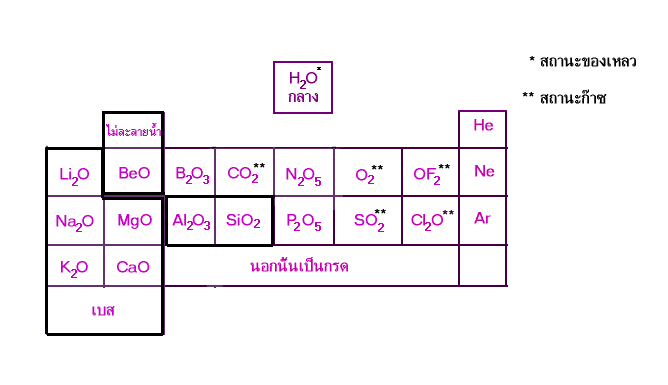 การเปรียบเทียบสารประกอบคลอไรด์ และ สารประกอบออกไซด
การเปรียบเทียบสารประกอบคลอไรด์ และ สารประกอบออกไซด
|
เปรียบเทียบ |
สารประกอบคลอไรด์ |
สารประกอบออกไซด์ | ||
|
โลหะ |
อโลหะ |
โลหะ |
อโลหะ | |
|
จุดหลอมเหลว |
สูง |
ต่ำ |
สูง |
ต่ำ |
|
สถานะ |
ของแข็ง |
ของแข็ง,ของเหลว, ก๊าซ |
ของแข็ง |
ของแข็ง, ของเหลว ก๊าซ |
|
ความเป็นกรด-เบส ของสารละลาย |
ส่วนมากเป็นกลาง หมู่(1-2) |
กรด |
ส่วนมากเป็นเบส หมู่(1-2) |
กรด |
สารประกอบคลอไรด์ในชีวิตประจำวัน
1. โซเดียมคลอไรด์ ( NaCl )
ใช้ปรุงรสอาหาร ถนอมอาหาร เป็นสารตั้งต้นในการผลิตโซเดียมไฮโดรเจนคาร์บอเนต ( NaHCO3 ) หรือโซดาทำขนม ,โซเดียมคาร์บอเนต ( NaCO3 ) หรือโซดาแอส , โซเดียมไฮดรอกไซด์ ( NaOH ) หรือโซดาไฟ และไฮโดรเจนคลอไรด์ ( HCl )ในต่างประเทศใช้ NaCl สำหรับละลายน้ำแข็งในหิมะ เป็นสารจำเป็นในร่างกาย คือ Na+ เป็นส่วนประกอบของของเหลวในร่างกาย
2. แคลเซียมคลอไรด์( CaCl2)
ใช้เป็นสารดูดความชื้น.ใช้ในเครื่องทำความเย็นในอุตสาหกรรมห้องเย็น. ใช้ทำฝนเทียม
3. โพแทสเซี่ยมคลอไรด์ (KCl ) ใช้ทำปุ๋ย
4. แอมโมเนียมคลอไรด์ ( NH3Cl )
ใช้เป็นน้ำประสารดีบุกและใช้เป็นอิเลคโทรไลต์มาเซลล์ถ่านไฟฉาย
5. NaClO , Ca(ClO)2
ใช้เป็นสารฟอกสี ฟอกขาวเยื่อกระดาษ . ใช้ฆ่าแบคทีเรียและสาหร่ายในน้ำประปา และในน้ำสระ
6. HCl ใช้กำจัดสนิมเหล็กก่อนที่จะฉาบสารกันสนิม
7. DDT ใช้เป็นยาฆ่าแมลง
8. ฟรีออน หรือสาร CFC
ใช้ทำความเย็น เป็นตัวขับดันในกระปํองสเปรย์
9. BFC ( โบรโมคลอโรไดฟลูออโรมีเทน )
เป็นสารที่ใช้ดับเพลิงในรถยนต์ และ เครื่องบิน
ใช้เป็นตัวทำละลายในการสกัดสารอินทรีย์
ก๊าฃเฉื่อย หรือ ก๊าฃมีตระกูล
สารประกอบของธาตุ 20 ธาตุแรก เรียงตามมวลอะตอม ปรากฎว่า ก๊าฃฮีเลียม นีออน และอาร์กอนไม่ทำปฏิกิริยากับคลอรีนและออกฃิเจน จึงเรียกธาตุกลลุ่มนี้ว่า ก๊าฃเฉื่อย ปัจจุบันพบว่า Kr และ Xeสามารถทำปฎิกิริยาโดยตรงกับฟลูออรีน เกิดเป็นสารประกอบฟลูออไรด์ เช่น KrF2 , XeF2 , XeF4 , XeF6นอกจากนี้ยังพบสารประกอบออกไฃด์ของฃีนอน เช่น XeO3 และ XeO4
ก๊าซเฉื่อย หรือ ก๊าซมีตระกูล มีคุณสมบัติดังนี้
1. เป็นก๊าซที่ไม่ค่อยทำปฏิกิริยากับก๊าซอื่นๆทัง้นี้เพราะมีอิเลคตรอนชั้นนอกสุด ( verent electron ) ครบ 8 อะตอม ( ยกเว้น He ที่มีแค่ 2 อะตอม )
2. มีสถานะเป็นก๊าซทั้งหมด ( 1 โมเลกุล ประกอบด้วย อะตอม 1 อะตอม ) ได้แก่ He , Ar , Ne , Kr ,Xe , Rn
3. ปัจจุบันพบก๊าซเฉื่อยบางชนิด เช่น Kr และ Xe สามารถทำปฏิกิริยากับ F และ O ได้ เช่น KrF2 ,XeF2 ,XeF4 ,
XeF6 , XeO3 , XeO4
4. ก๊าซเฉื่อยมีแรงยึดเหนี่ยวระหว่างโมเลกุลเป็น " วันเดอร์วาลส์ " จึงทำให้มีจุดเดือด จุดหลอมเหลวต่ำ
ประโยชน์ของก๊าซเฉื่อย
1. He ผสมกับ O2ในอัตราส่วน 4 :1 โดยปริมาตรใช้เป็นอากาศหายใจของนักประดาน้ำที่ทำงานใต้ทะเลลึก ซึ่งมีความกดดันสูงเนื่องจากฮีเลียมละลายในเลือดได้น้อย ถ้าหายใจด้วยอากาศปกติ ซึ่งมีเปอร์เซ็นต์ของไนโตรเจนอยู่มากก๊าซไนโตรเจนนี้สามารถละลายในเลือดได้ดีที่ความดันสูงๆ เมื่อนักประดาน้ำกลับขึ้นสู่ผิวน้ำซึ่งมีความดันปกติไนโตรเจนละลายได้น้อยก็แยกตัวออกจากเลือดเป็นฟองก๊าซอยู่ในอวัยวะ เช่น หลอดเลือด กล้ามเนื้อ
ทำให้เจ็บปวดมาก
2. He และ Ar ใช้เป็นสารหล่อเย็นเพื่อศึกษาสมบัติของสารที่อุณหภูมิต่ำ
3. Ne และ Ar ใช้เป็นก๊าซบรรจุในหลอดไฟเพื่อยืดอายุการใช้งานของไส้หลอด
4. ก๊าซเฉื่อยใช้ในหลอดไฟโฆษณาเพื่อให้แสงสีต่างๆ
He ให้แสง สีชมพู Ne ให้แสง สีชมพู Ar ให้แสง สีม่วงน้ำเงิน
5. Kr (คริปตอน) ใช้ในหลอดไฟแฟลชสำหรับถ่ายรูปด้วยความเร็วสูง
6. Xe(ซีนอน) เป็นก๊าซที่ช่วยให้สลบ
7. Rn(เรดอน)เป็นธาตุกัมมันตรังสี ใช้ในการบำบัดรักษามะเร็ง
8. Ar และ Kr บรรจุในหลอดผลิตแสงเลเซอร์ เพื่อใช้เป็นตัวกลางที่ทำให้แสงเลเซอร์มีความถี่ต่างๆกันได้
ธาตุ และ สารประกอบที่สำคัญต่าง ๆ
แคลเซียม (Ca) เป็นธาตุหมู่ 2 มีความแข็งแรงพอใช้เป็นโลหะที่มีเงาวาว เบาถ้าถูกับไอน้ำในอากาศมันจะหมดเงาทันที ทำปฏิกิริยากับน้ำได้ไฮโดรเจน
แคลเซียมคาร์บอเนต (CaCO3) พบมากในธรรมชาติเกิดอยู่ในแบบของ Limestone , marble ,ชอล์ก , หอย , เปลือกหอยกาบ และไข่มุก CaCO3ที่บริสุทธิ์ จะมีสีขาว CaCO3ที่อยู่ในรูปแบบของ marble ใช้ประโยชน์ในการก่อสร้าง แต่ถ้าอยู่ในรูป Limestone ผสม clayแล้วให้ความร้อนจะให้ซีเมนต์
แคลเซียมฟอสเฟต [Ca3(PO4)2] พบมากอยในมลรัฐฟอริดา อยู่ในกระดูกมีประโยชน์ใช้ทำปุ๋ยซึ่งอยู่ในรูป super phosphate
แคลเซียมซัลเฟต [CaSO4.2H2O] มีอยู่ในธรรมชาติในชื่อ ยิปซัม ใช้ในการกสิกรรมเพื่อทำให้ดินดีและยังใช้ในอุตสาหกรรทำปูนปลาสเตอร์
อะลูมิเนียม (AL) เป็นธาตุที่มีมากเป็นที่ 3 ในโลก ผุ้พบอะลูมิเนียมเป็นคนแรกคือ Hans ChristanOersteอะลูมิเนียมเป็นโลหะที่สำคัญมากและยังราคาถูก ในอุตสาหกรรม ใช้อะลูมิเนียมมากที่สุด ผสมกับธาตุอื่นเป็นโลหะผสม (Alloys) สารประกอบอะลูมิเนียม ได้แก่
อะลูมิเนียมออกไซด์ (Al2O3) บางทีเรียกคอรันดัม มีความแข็งมากเกือบเท่าเพชร บางที่เรียกEmery บุษราคัม Sapphire ทับทิมก็เป็นพวกอะลูมิเนียมออกไซค์ที่ไม่บริสุทธิ์
สารส้ม ใช้แกว่งน้ำให้ตะกอนตกก้นตุ่ม
กัวลีน ใช้ประโยชน์คือ เอาทำเครื่องเคลือบดินเผา
เหล็ก (Fe) เป็นธาตุที่มีมากเป็นที 4 ในโลก ซึ่งเหล็กนี้ได้จากการถลุงเหล็ก โดยใช้เตาบลาสเฟอร์เนส(BlastFurnace) เหล็กที่ได้มาจาก Blast Furnace เป็นเหล็กที่ไม่บริสุทธิ์เรียก Pigiron
เหล็กกล้า เป็นเหล็กที่ใช้ประโยชน์มาก เช่น ทำขัน ทำขบวนรถไฟ
คุณสมบัติและประโยชน์ที่เหล็กกล้าถูกสารอื่นผสมมีดังนี้
I.เติมโครเมียม (Cr) ทำให้เหล็กเหนียว แข็ง ใช้ทำมีดโกน เกียร์รถยนต์ เหล็กกล้ากันสนิม (StainlessSteel)
II.เติมนิเกิล (Ni) ทำให้เหล็กเหนี่ยวไม่เปราะ ใช้ทำชิ้นส่วนรถยนต์
III.เติมแมงกานีส (Mn) ทำให้เหล็กแข็งและเหนี่ยว ใช้ทำตู้นิรภัย ชิ้นส่วนเรือรบ
IV.เติมทังสเตน (V) ทำให้เหล็กเหนียว ใช้ทำชิ้นส่วนรถยนต์
ทองแดง (Cu) ซึ่งพบมากในธรรมชาติเกิดในรูปของสินแร่ต่างๆ และมีอยู่ในเลือดของสัตว์บางชนิด คือ มีใน Haemocyanin ทองแดงมีคุณสมบัติเป็นโลหะ เป็นตัวนำไฟฟ้าที่ดีมากลงมาจากเงิน
ทองเหลือง (Brass) คือ ทองแดงผสมกับสังกะสี ใช้ทำกุญแจ ปลอกกระสุนปืน กรอบประตู ฯลฯ
บรอนซ์ (Bronze) บางทีเรียกสัมฤทธิ์ ลงหินหรือทองม้าล่อ คือ ทองแดงผสมกับดีบุก ในอัตราส่วนต่างๆกัน
จุนสี เป็นสารประกอบที่สำคัญของทองแดง บางทีเรียก Blue Vitriol มนุษย์ใช้จุนสีฆ่าเห็ดรา(Fungicide) ฆ่าเชื้อโรคจัดเป็นพวกยาประเภท Germicide
เงิน (Ag) เป็นสื่อไฟฟ้าและความร้อนที่ดีที่สุด ทนทานต่อการกัดกร่อนของกรดอินทรีย์ และโซดาไฟ
ทองคำ (Au) เป็นธาตุที่หายากมา มีในโลกประมาณ 1 เท่า ของเงินความบริสุทธิ์ของทองคำใช้วัดเป็นกะรัต ทองคำที่บริสุทธิ์จริงคือ ทองคำ 24 กะรัต ทองคำนี้ใช้ทำทองขาวเทียม(White gold) ซึ่งมีสีคล้ายทองขาว ประกอบด้วยทอง 80 % นิกเกิล 20%
โคบอลท์ (Co) โลหะนี้ผสมกับเหล็กกล้าเพื่อใช้เป็นเครื่องมือตัดโลหะ ประโยชน์สำคัญมากใช้ทำโคบอลท์60 เพื่อการรักษามะเร็ง
ทังสเตน (W) ปัจจุบันใช้ทำเส้นใยหลอดไฟฟ้า ใช้ผสมกับเหล็กใช้ทำ tungsten carbideซึ่งจัดว่าเป็นสารที่แข็งมาก ใช้ประกอบเครื่องมือตัดโลหะด้วยความเร็วสูง
เยอรเมเนียม (Ge) เป็นธาตุที่หายากมาก ใช้เป็นส่วนประกอบ ของเครื่องทรานซิสเตอร์และใช้ในเครื่องอิเล็กทรอนิกส์ต่างๆ
ตารางแสดงสมบัติทางกายภาพของโลหะกับอโลหะ
|
สมบัติของธาตุ |
โลหะ |
อโลหะ |
|
1.มีสถานะ |
เป็นของแข็งยกเว้นปรอท (Hg ) |
มีทั้ง 3สถานะ คือของแข็ง เช่นคาร์บอน ของเหลว เช่น โบรมีนก๊าซเช่น ไนโตรเจน |
|
2.การนำไฟฟ้า ความร้อน |
นำได้ดี |
ไม่ นำ ยกเว้นแกรไฟต์ |
|
3.ความมันวาว |
ตัดหรือขัดเป็นมันวาว |
ไม่มันวาว |
|
4. จุดหลอมเหลว |
สูงยกเว้นปรอท |
ต่ำ ยกเว้นคาร์บอน |
|
5.ช่วงกว้างระหว่างจุดเดือด และจุดหลอมเหลว |
กว้าง |
แคบ ยกเว้น คาร์บอน |
|
6.ความหนาแน่น |
มีทั้งสูงและต่ำ |
ต่ำ |
|
7.ความแข็งและเหนียว |
แข็งและเหนียว สามารถทำให้เป็นแผ่นและเส้นได้ |
ส่วนมากมักเปาะ |
ธาตุกึ่งโลหะ หรือ เมตัลลอยด์ ( Metalloid )
ถ้าดูในตารางธาตุจะอยู่ในบริเวณรอยต่อที่แบ่งเขตความเป็นโลหะกับอโลหะ เช่น B , Al , Si , Ge , As , Sb ,Te และ Po นำไฟฟ้าได้น้อยแต่ถ้าอุณหภูมิสูงจะนำไฟฟ้าได้ดีขึ้น
ในสมัยคริสตวรรษที่ 18 W. Lewis นักเคมีชาวอังกฤษเป็นนักวิทยาศาสตร์คนแรกที่เรียกโลหะเช่น ทองคำ แพลททินัม พัลลาเดียม ฯลฯ ว่าเป็นโลหะมีตระกูล (noble metal) เพราะโลหะเหล่านี้เชื่องช้าไม่กระตือรือร้นในการทำปฏิกิริยาทางเคมีกับธาตุอื่นๆเลย
นั่นเป็นเรื่องในอดีต แต่ในปัจจุบัน นักเคมีกำลังประสบความสำเร็จในการนำโลหะมีตระกูลเหล่านี้ มาทำปฏิกิริยาเคมีกับสารอื่นๆเป็นสารประกอบที่สามารถใช้เป็นวัสดุชนิดใหม่ๆ ซึ่งกำลังมีบทบาทสำคัญในการปฏิวัติ ปฏิรูปวงการเทคโนโลยีและอุตสาหกรรมต่างๆมากมาย วิธีหนึ่งที่ใช้ในการสังเคราะห์วัสดุที่ประกอบด้วยโลหะมีตระกูลเป็นดังนี้ นักเคมีจะเผาโลหะในเตาสุญญากาศจนกระทั่งอุณหภูมิร้อนจัดถึง 5,000 องศาเซลเซียส ที่อุณหภูมิสูงเช่นนี้ โลหะจะระเหยเป็นไอ อะตอมที่มีสภาพเป็นไอมีสมบัติทางเคมีแตกต่างจากอะตอมของธาตุเดียวกันที่อยู่ในสภาพของแข็งก็เช่นกันเวลาอยู่คนเดียวกับเวลาอยู่กันหลายคน จะมีพฤติกรรมที่แตกต่างกัน ฉันใดก็ฉันนั้น อะตอมที่อิสระเหล่านี้จะเคลื่อนที่ว่องไวและพร้อมที่จะทำปฏิกิริยาเคมีกับอะตอมอย่างอื่นๆ
ดังนั้นเวลามันปะทะละอองแก๊สอื่นๆ เช่น คาร์บอนหรือไฮโดรเจน มันจะจับตัวกัน และเมื่อมันลอยไปปะทะผนังที่เย็นจัดกลุ่มอะตอมจะกลั่นตัวจับแข็งเป็นสารประกอบชนิดใหม่ นักเคมีใช้เทคนิคนี้ในการทำสารประกอบ mercurochrome (ยาแดง) สาร tetraethyl ที่ใช้ในน้ำมันรถยนต์ป้องกันการน๊อก และ alkyls ที่ใช้ในยาฆ่ารา เป็นต้น
ส่วน krypton ซึ่งเป็นแก๊สมีตระกูลนั้นก็เช่นกัน ในตามปรกติอะตอมของ Krypton จะอยู่โดดๆ คือไม่จับกลุ่มกับอะตอมใดและไม่จับกลุ่มกันเองด้วย เมื่อปี พ.ศ. 2535 P. Lethbridge และ T. Stace แห่งมหาวิทยาลัย Sussex ประเทศอังกฤษ ได้ประสบความสำเร็จในการทำให้อะตอมของ krypton จับตัวเป็นกลุ่ม (cluster) ที่ประกอบด้วย krypton ถึง 309 อะตอม กลุ่มอะตอมนี้มีขนาดใหญ่กว่าอะตอมของ Krypton เดี่ยวมาก และมีสมบัติทางเคมีที่น่าสนใจเพราะสามารถใช้เป็นสารเร่งปฏิกิริยาเคมี (catalyst) ที่วิเศษได้
ในการสังเคราะห์กลุ่มอะตอม krypton นั้น นักวิทยาศาสตร์ทั้งสองให้ แก๊ส krypton ผ่านรูเล็กๆ ขนาดเส้นผ่าศูนย์กลาง0.2 มิลลิเมตร แล้วให้แก๊สขยายตัวในสุญญากาศ ผลการขยายตัวทำให้อุณหภูมิของแก๊สลดลง ดังนั้นเวลาอะตอมของแก๊สปะทะกันแรงดึงดูดแบบ Van der Waal ระหว่างอะตอมจะมากพอที่จะยึดเหนี่ยวอะตอมเหล่านี้ให้จับกลุ่มกันได้ เป็นแก๊สที่มีสูตรเป็นKrn ซึ่ง n มีค่าตั้งแต่ 10 ถึง 340
การวิเคราะห์สเปกตรัมของอะตอมกลุ่มนี้ ทำให้นักเคมีทั้งสองรู้จำนวนอะตอมที่ประกอบกันเป็นกลุ่มได้ และพบว่าอะตอมที่เสถียรกลุ่มนี้มักจะเรียงซ้อนกันเป็น 3 ชั้นบ้าง 4 ชั้นบ้าง และมีโครงสร้างเป็นรูปทรงที่มี 20 หน้าสม่ำเสมอ (icosohedral)ซึ่งโครงสร้างลักษณะนี้ไม่มีในของแข็งที่พบในธรรมชาติ
ในการประชุม International Chemical Conference of Pacific Basin Societies ที่ Honoluluสหรัฐอเมริกา เมื่อเดือนธันวาคม พ.ศ. 2534 O. Chapman แห่งมหาวิทยาลัย California ที่ Los Angelesได้ทำให้วงการเคมีตะลึง เมื่อเขาประกาศว่า เขาประสบความสำเร็จในการสังเคราะห์สารใหม่ชนิดหนึ่งชื่อ Azite ซึ่งมีลักษณะคล้ายเซรามิกที่แข็งแรงพอๆ กับหินคว๊อท แต่มีน้ำหนักเบากว่า และเขาได้พบว่า Azite สามารถนำไฟฟ้าได้ดีคือ ไม่ดูดซึมน้ำและทนความร้อนได้สูง และที่น่าตื่นเต้นที่สุดคือสูตรโครงสร้างของAzite เป็น C60 ที่มีลักษณะเป็นทรงกลม คล้ายลูกฟุตบอลนี้ นับเป็นครั้งแรกที่นักเคมีสามารถสังเคราะห์ธาตุคาร์บอน ให้มีลักษณะกลมเช่นนี้ได้
วัสดุใหม่ๆ ที่นักวิทยาศาสตร์สังเคราะห์ขึ้นมานี้ จะมีประโยชน์เพียงใดหรือไม่ เป็นเรื่องที่นักวิทยาศาสตร์ต้องวิจัยค้นคว้าต่อไปเพราะในสายตานักวิทยาศาสตร์ปัจจุบัน เราอาจจะมองไม่เห็นคุณประโยชน์อันใดก็เป็นไปได้
แต่ในสายตานักวิทยาศาสตร์อนาคต วัสดุเหล่านี้อาจพลิกโฉมวงการอิเล็กทรอนิกคอมพิวเตอร์ และอวกาศก็ได้