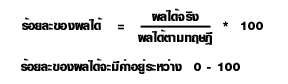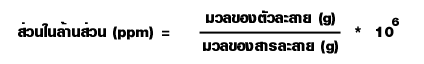 หรืออาจใช้แสดงปริมาณของสิ่งเจือปนที่มีอยู่ในสารเคมีที่บริสุทธิ์ต่างๆ เช่น
สารละลายโพแทสเซียมไนเตรตเข้มข้น 2 ppm หมายความว่ามีโพแทสเซียมไนเตรตเป็นตัวละลาย
2 ส่วน(กรัม) ละลายอยู่ในสารละลาย 1 ล้านส่วน (กรัม) หรือ 106 กรัม
หรืออาจใช้แสดงปริมาณของสิ่งเจือปนที่มีอยู่ในสารเคมีที่บริสุทธิ์ต่างๆ เช่น
สารละลายโพแทสเซียมไนเตรตเข้มข้น 2 ppm หมายความว่ามีโพแทสเซียมไนเตรตเป็นตัวละลาย
2 ส่วน(กรัม) ละลายอยู่ในสารละลาย 1 ล้านส่วน (กรัม) หรือ 106 กรัมปริมาณสารสัมพันธ์ 2
สารละลาย
สารละลาย (Solution) คือ สารเนื้อเดียวที่มีสารตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน ประกอบด้วยตัวทำละลายและตัวถูกละลายถ้าตัวถูกสารละลายและตัวทำละลายมีสถานะเดียวกันสารละลายที่มีปริมาณมากกว่าเป็นตัวทำละลาย แต่ถ้าสารทั้งสองมีสถานะแตกต่างกันสารที่มีสถานะเดียวกันกับสารละลายเป็นตัวทำละลาย
หน่วยของสารละลาย เป็นค่าที่แสดงถึงปริมาณของตัวละลายที่ละลายอยู่ในตัวทำละลายหรือในสารละลายนั้นวัดในรูปความเข้มข้นปริมาณตัวถูกละลายต่อปริมาณสารละลาย (ยกเว้นหน่วยโมลต่อกิโลกรัม)
1. ร้อยละ
1.1 ร้อยละโดยมวล(มวล/มวล) คือ ปริมาณมวลของตัวถูกละลายในมวลของสารละลาย 100 หน่วยมวล
1.2 ร้อยละโดยปริมาตร(ปริมาตร/ปริมาตร) คือ ปริมาตรของตัวถูกละลายในสารละลายปริมาตร 100 หน่วยปริมาตร
นิยมใช้กับสารละลายที่เป็นของเหลว เช่น สารละลายแอลกอฮอล์เข้มข้นร้อยละ 20 โดยปริมาตร หมายความว่าสารละลายนี้100 ลูกบาศก์เซนติเมตรจะมีแอลกอฮอล์ละลายอยู่ 20 ลูกบาศก์เซนติเมตร1.3 ร้อยละมวลต่อปริมาตร คือ ปริมาณของตัวถูกละลายในปริมาตรของสารละลาย 100 หน่วยปริมาตร โดยทั่วไปถ้ามวลของตัวถูกละลายมีหน่วยเป็นกรัมปริมาตรของสารละลายจะมีหน่วยเป็นลูกบาศก์เซนติเมตร และถ้ามวลของตัวถูกละลายมีหน่วยเป็นกิโลกรัม ปริมาตรของสารละลายจะมีหน่วยเป็นลูกบาศก์เดซิเมตรหรือลิตร หน่วยมวลและหน่วยปริมาตรต้องให้สอดคล้องกันด้วย
2. โมลาริตี หรือโมลต่อลูกบาศก์เดซิเมตร (mol/dm3 หรือ mol/l) เป็นหน่วยที่บอกจำนวนโมลของตัวถูกละลายในสารละลาย 1 ลูกบาศก์เดซิเมตร หน่วยความเข้มข้นเป็นโมลต่อลูกบาศก์เดซิเมตรอาจเรียกย่อได้เป็นโมลาร์(Molar) ใช้สัญลักษณ์ M
3. โมแลลิตี หรือ โมลต่อกิโลกรัม (mol/kg) เป็นหน่วยที่บอกจำนวนโมลของตัวถูกละลายที่ละลาย ในตัวทำละลาย1 กิโลกรัม จึงมีหน่วยเป็น mol/kg หรือเรียกว่า โมแลล (Molal) ใช้สัญลักษณ์ m
4. เศษส่วนโมล (Mole fractions) คือ สัดส่วนจำนวนโมลของสารองค์ประกอบหนึ่งต่อจำนวนโมลรวมของสารทุกชนิดในสารละลาย ใช้สัญลักษณ์ X เช่น สารละลายชนิดหนึ่งประกอบด้วยสาร A a mol, B b mol และC c mol จะได้เศษส่วนโมลของสาร A, B และ C ดังนี้
เศษส่วนโมลของสาร A (XA) = a / ( a + b + c )
เศษส่วนโมลของสาร B (XB) = b / ( a + b + c )
เศษส่วนโมลของสาร C (XC) = c / ( a + b + c )
ผลรวมของเศษส่วนโมลของสารองค์ประกอบทั้งหมดคือ XA + XB + XC มีค่าเท่ากับ 1
และเมื่อนำค่าเศษส่วนโมลของแต่ละสารมาคูณด้วยร้อย จะได้ความเข้มข้นในหน่วยร้อยละโดยมวลของสารนั้น
ร้อยละโดยมวลของสาร A = เศษส่วนโมลของสาร A * 100
ร้อยละโดยมวลของสาร B = เศษส่วนโมลของสาร B * 100
ร้อยละโดยมวลของสาร C = เศษส่วนโมลของสาร C * 100
5. ส่วนในล้านส่วน (parts per million; ppm) เป็นหน่วยที่บอกมวลของตัวถูกละลายที่ละลายอยู่ในสารละลาย1 ล้านหน่วยมวลเดียวกัน ซึ่งเป็นหน่วยความเข้มข้นของสารละลายที่เจือจางมาก ๆ
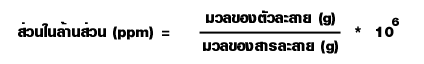 หรืออาจใช้แสดงปริมาณของสิ่งเจือปนที่มีอยู่ในสารเคมีที่บริสุทธิ์ต่างๆ เช่น
สารละลายโพแทสเซียมไนเตรตเข้มข้น 2 ppm หมายความว่ามีโพแทสเซียมไนเตรตเป็นตัวละลาย
2 ส่วน(กรัม) ละลายอยู่ในสารละลาย 1 ล้านส่วน (กรัม) หรือ 106 กรัม
หรืออาจใช้แสดงปริมาณของสิ่งเจือปนที่มีอยู่ในสารเคมีที่บริสุทธิ์ต่างๆ เช่น
สารละลายโพแทสเซียมไนเตรตเข้มข้น 2 ppm หมายความว่ามีโพแทสเซียมไนเตรตเป็นตัวละลาย
2 ส่วน(กรัม) ละลายอยู่ในสารละลาย 1 ล้านส่วน (กรัม) หรือ 106 กรัม
ในกรณีที่สารละลายเจือจางมากๆ มวลของสารละลายมีค่าน้อยมากเมื่อเทียบกับมวลของตัวทำละลาย ทำให้มวลของสารละลายมีค่าใกล้เคียงกันมากกับมวลของตัวทำละลายจนถือว่าเท่ากันได้
สรุปสูตรการคำนวน
![]() 1. ร้อยละโดยมวลของตัวถูกละลาย
1. ร้อยละโดยมวลของตัวถูกละลาย
![]() 2. ร้อยละโดยปริมาตรของตัวถูกละลาย
2. ร้อยละโดยปริมาตรของตัวถูกละลาย
![]() 3. ร้อยละโดยมวลต่อปริมาตรของตัวถูกละลาย
3. ร้อยละโดยมวลต่อปริมาตรของตัวถูกละลาย
![]() 4. mol/dm3
4. mol/dm3
![]() 5. mol/kg
5. mol/kg
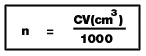 6. สารละลายที่มีความเข้มข้น C mol/dm3
จำนวน V cm3 จำนวนโมลของตัวถูกละลาย n mol
6. สารละลายที่มีความเข้มข้น C mol/dm3
จำนวน V cm3 จำนวนโมลของตัวถูกละลาย n mol
7. การเปลี่ยนหน่วยสารละลายจากหน่วย ร้อยละ -----------> mol/dm3
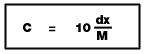 7.1 ร้อยละโดยมวล --------->
mol/dm3
7.1 ร้อยละโดยมวล --------->
mol/dm3
C = ความเข้มข้น (mol/dm3) d = ความหนาแน่นของสารละลาย (g/cm3)
X = ความเข้มข้น (% โดยมวล) M = มวลโมเลกุลของตัวถูกละลาย
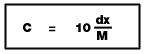 7.2 ร้อยละโดยปริมาตร
--------------> mol/dm3
7.2 ร้อยละโดยปริมาตร
--------------> mol/dm3
D = ความหนาแน่นของตัวทำละลาย (g/cm3) x = ความเข้มข้นของสารละลาย (% โดยปริมาตร)
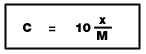 8.3 ร้อยละโดยมวลต่อปริมาตร
---------------> mol/dm3
8.3 ร้อยละโดยมวลต่อปริมาตร
---------------> mol/dm3
X = ความเข้มข้นของสารละลาย (ร้อยละมวลต่อปริมาตร)
8. การเตรียมสารละลายเจือจางโดยการเติมน้ำ
โมลของตัวถูกละลายก่อนเติมน้ำ = โมลของตัวถูกละลายหลังเติมน้ำ
สารละลาย C1 mol/dm3 จำนวน V1 cm3 เติมน้ำเป็นสารละลาย C2 mol/dm3 จำนวน V2 cm3
![]()
C1 V1 และ C แทนความเข้มข้นของสารละลายมีหน่วยเป็น mol/dm3
![]() C2 V2 และ V
แทนปริมาตรของสารละลายมีหน่วยสอดคล้องกัน เช่น cm3 หรือ dm3 เหมือนกัน
C2 V2 และ V
แทนปริมาตรของสารละลายมีหน่วยสอดคล้องกัน เช่น cm3 หรือ dm3 เหมือนกัน
สมบัติคอลลิเกตีฟของสารละลาย
สารละลายเป็นสารเนื้อเดียวที่ได้จากการผสมสารบริสุทธ์ตั้งแต่ 2 ชนิดขึ้นไปเข้าด้วยกัน ถ้าสารที่นำมาผสมกันมีสถานะเดียวกันจะถือว่าสารที่มีปริมาณมากที่สุดเป็นตัวทำละลายส่วนสารที่มีปริมาณน้อยกว่าเป็นตัวละลาย จุดเดือดของสารละลายสูงกว่าตัวทำละลายบริสุทธิ์ และจุดหลอมเหลวของสารละลายต่ำกว่าตัวทำทำละลายบริสุทธิ์และถ้าสารละลายที่มีความเข้มข้นในหน่วยโมลต่อกิโลกรัมเท่ากัน จะมีจุดเดือดและจุดหลอมเหลวเท่ากัน โดยที่ตัวละลายจะเป็นสารใดก็ได้แต่ต้องเป็นสารที่ระเหยยากและไม่แตกตัวเป็นไอออนส่วนสารละลายที่มีความเข้มข้นต่างกัน แม้จะมีตัวทำละละายชนิดเดียวกันก็มีค่าจุดเดือดและจุดหลอมเหลวไม่เท่ากัน
สูตรเกี่ยวกับสารละลายที่มีสมบัติคอลลิเกตีฟ
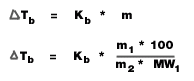
Tb = จุดเดือดของสารละลาย - จุดเดือดของตัวทำละลาย (องศาเซลเซียส)
Kb = ค่าคงที่ของการเพิ่มขึ้นของจุดเดือดของสารละลาย (องศาเซลเซียส/mol/kg)
m = ความเข้มข้นของสารละลาย (mol/kg)
m1 = มวลตัวถูกละลาย (g)
m2 = มวลของตัวทำละลาย (g)
MW1 = มวลโมเลกุลของตัวถูกละลาย
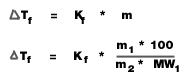
Tf = จุดเยือกแข็งของตัวทำละลาย - จุดเยือกแข็งของสารละลาย (องศาเซลเซียส)
Kf = ค่าคงที่ของการลดลงของจุดเยือกแข็งของสารละลาย (องศาเซลเซียส/mol/kg)
3.สารละลายชนิดเดียวกันมีความเข้มข้นเท่ากัน จุดเดือดและจุดเยือกแข็งสัมพันธ์กันดังนี้
![]()
มวลของสารในปฏิกิริยาเคมี
การเปลี่ยนแปลงของสารในปฏิกิริยาใดๆ ต้องมีการกำหนดขอบเขตการศึกษา ซึ่งมีองค์ประกอบที่สำคัญอยู่ 2 ส่วนคือ ส่วนที่อยู่ภายในขอบเขตของการศึกษาซึ่งรวมทั้งก่อนการเปลี่ยนแปลงและหลังการเปลี่ยนแปลงเรียกว่า ระบบ กับส่วนที่อยู่นอกขอบเขตที่ศึกษา เช่นภาชนะ อุปกรณ์ หรือเครื่องมือวัดต่างๆเรียกว่า สิ่งแวดล้อม เช่น การทำน้ำให้เป็นน้ำแข็ง ระบบก่อนการเปลี่ยนแปลงคือน้ำ และระบบหลังการเปลี่ยนแปลงคือน้ำแข็ง ส่วนสิ่งแวดล้อมก็คือภาชนะ ระบบมีอยู่2 ระบบดังนี้
1. ระบบปิด คือ ระบบที่ไม่มีการถ่ายเทมวลของสารระหว่างระบบกับสิ่งแวดล้อม
2. ระบบเปิด คือ ระบบที่มีการถ่ายเทมวลของสารระหว่างระบบกับสิ่งแวดล้อม
การศึกษาการเปลี่ยนแปลงของสารจำเป็นต้องระบุสมบัติต่างๆ ของระบบ เช่น มวล อุณหภูมิ ปริมาตร ความดัน ถ้าตรวจสอบได้ว่าสมบัติใดของระบบมีการเปลี่ยนแปลงก็ถือได้ว่ามีการเปลี่ยนแปลงเกิดขึ้นในระบบ สมบัติของสารและปัจจัยที่มีผลต่อสมบัติของระบบเรียกว่าภาวะของระบบ
ในปี พ.ศ. 2317 อองตวน-โลรอง ลาวัวซิเอ ได้ทดลองเผาสารในหลอดที่ปิดสนิทพบว่า มวลรวมของสารก่อนเกิดปฏิกิริยาเท่ากับมวลรวมของสารหลังทำปฏิกิริยา จึงตั้งเป็นกฎเรียกว่า กฎทรงมวล
โจเชฟ เพราสต์ ได้ศึกษาการเตรียมสารประกอบบางชนิด
พบว่าสารประกอบชนิดหนึ่งที่เตรียมด้วยวิธีการที่แตกต่างกันมีอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่งๆ จะมีค่าคงที่ จึงตั้งเป็นกฎเรียกว่า กฎสัดส่วนคงที่ ตัวอย่างเช่น สารประกอบคอปเปอร์(II)ซัลไฟด์ ( CuS ) ที่เกิดจากการรวมตัวของทองแดงและกำมะถันจะมีอัตราส่วนโดยมวลเท่ากับ2:1 เสมอ
ปริมาตรก๊าซในปฏิกิริยาเคมี
ก๊าซมีสมบัติฟุ้งกระจายและมีมวลน้อยมาก การวัดมวลโดยตรงทำได้ยากจึงนิยมวัดในหน่วยปริมาตร
ซึ่งสามารถอธิบายโดยใช้กฎดังต่อไปนี้
1. กฎของเกย์ลุสแซก
ในปี พ.ศ. 2531 โซเซฟ-ลุย-เก-ลูซัก
ได้ทดลองวัดปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่ได้จากปฏิกิริยาณ อุณหภมิและความดันเดียวกัน แล้วสรุปเป็นกฎการรวมปริมาตรของก๊าซว่า "ในปฏิกิริยาเคมีที่เป็นก๊าซ อัตราส่วนโดยปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่เกิดจากปฏิกิริยาที่อุณหภูมิและความดันเดียวกัน จะเป็นเลขจำนวนเต็มลงตัวน้อย ๆ"
2. กฎอาโวกาโดร
ในปี พ.ศ. 2354 อาเมเดโอ อาโวกาโดร ได้ศึกษากฎของเกย์-ลูสแซกและอธิบายว่าการที่อัตราส่วนโดยปริมาตรของก๊าซที่เข้าทำปฎิกิริยาและที่ได้จากปฏิกิริยาเป็นเลขจำนวนเต็มน้อยๆคงเป็นเพราะปริมาตรของก๊าซมีความสัมพันธ์กับจำนวนอนุภาคที่รวมตัวกันเป็นสารประกอบ อาโวกาโดรจึงเสนอสมสุติฐานว่า"ที่อุณหภูมิและความดันเดียวกัน ก๊าซทุกชนิดที่มีปริมาตรเท่ากันจะมีจำนวนโมเลกุลเท่ากัน"เช่น ปฏิกิริยาระหว่างก๊าซไฮโดรเจนกับก๊าซออกซิเจนจนเกิดเป็นไอน้ำ
ไฮโดรเจน + ออกซิเจน -------> ไอน้ำ
2 cm3 1 cm3 2 cm3
2n โมเลกุล
2 โมเลกุล
1 โมเลกุล 2 โมเลกุลหรือ 1 โมเลกุล
หรือ 2 อะตอม
1 อะตอม 2 อะตอมหมายเหตุ
อัตราส่วนโดยปริมาตรของก๊าซต่าง ๆ ในปฏิกิริยาจะเท่ากับอัตราส่วนโดยโมลของก๊าซต่าง ๆ
ในปฏิกิริยาเดียวกันนั้น เช่น
N2(g) + 3H2(g) ------> 2NH3(g)อัตราส่วนโดยปริมาตร N2 : H2 : NH3 = 1 : 3 : 2
อัตราส่วนโดยโมล N2 : H2 : NH3 = 1 : 3 : 2
การหาสูตรเอมพิรีคัล
สูตรเอมพิริคัล เป็นสูตรที่แสดงอัตราส่วนอย่างต่ำของธาตุองค์ประกอบ เช่น ไฮโดรเจนเปอร์ออกไซด์มีสูตรโมเลกุลเป็น H2O2 อัตราส่วนอย่างต่ำของจำนวนอะตอม H : O เท่ากับ 1 : 1 สูตรเอมพิริคัลจึงเป็น HO กลูโคสมีสูตรโมเลกุลเป็น C6H12O6 อัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O เท่ากับ 1 : 2 : 1 สูตรเอมพิริคัลจึงเป็น CH2O
การหาสูตรเอมพิริคัล มีหลักดังนี้
1. ต้องทราบว่าสารที่จะหาสูตรเอมพิริคัลประกอบด้วยธาตุใดบ้าง
2. ต้องทราบมวลอะตอมของแต่ละธาตุในสารที่จะหาสูตรเอาพิริคัล
3. ต้องทราบมวลของแต่ละธาตุในสารที่จะหาสูตร
4. ให้ข้อมูลจากข้อ 1, 2 และ 3 หาอัตราส่วนโดยโมล ด้วยการนำมวลของแต่ละธาตุหารด้วยมวลอะตอมของมันมาเข้าอัตราส่วน
5. สำหรับการปัดจุดทศนิยมของตัวเลขในการหาอัตราส่วนโดยโมล โดยทำตัวเลขใดตัวเลขหนึ่ง ให้เป็น 1 แล้วจึงปัดจุดทศนิยมด้วยวิธีปัด 0.1 - 0.2 ทิ้ง ถ้าเป็น 0.8 - 0.9 ปัดขึ้นอีก 1 ถ้าเป็น 0.0 - 0.7
ปัดไม่ได้ต้องหาตัวเลขที่ต่ำที่สุดมาคูณตัวเลขของอัตราส่วนโดยโมลให้มีค่าใกล้กับที่จะปัดจุดทศนิยมได้ แล้วปัดจุดทศนิยมตัวเลขให้เป็นจำนวนเต็ม อนึ่งการปัดจุดทศนิยม ถ้าตัวเลขปัดจุดทศนิยมไม่ได้
ตัวเลขทุกตัวของอัตราส่วนโดยโมลนั้นก็จะไม่ปัดจุดทศนิยม หาตัวเลข มาคูณให้ได้ตัวเลขที่จะปัดจุดทศนิยมได้อัตราส่วนโดยโมลที่เป็นจำนวนเต็มได้สูตรเอมพิริคัล
การหาสูตรโมเลกุลของสารทั่วไป
สูตรโมเลกุลเป็นสูตรที่แสดงจำนวนอะตอมของธาตุองค์ประกอบที่มีอยู่ใน 1 โมเลกุลของสาร เช่น
ไฮโดรเจนมีสูตรโมเลกุลเป็น H2 แสดงว่า 1 โมเลกุลประกอบด้วยไฮโดรเจน 2 อะตอม ไฮโดรเจนเปอร์ออกไซด์มีสูตรโมเลกุลเป็น H2O2 แสดงว่า
1 โมเลกุลประกอบด้วยไฮโดรเจนและออกซิเจนธาตุละ 2 อะตอม
การหาสูตรโมเลกุลของสารทั่วไป มีหลักดังนี้
1. ต้องทราบสูตรเอมพิริคัล
2. ต้องทราบมวลโมเลกุลโดยโจทย์กำหนดมาให้ทางตรงหรือทางอ้อมก็ได้
3. นำข้อมูลที่ได้จากข้อ 1, 2 หาค่า n โดยใช้สูตร
(มวลของสูตรเอมพิริคัล) x n = มวลโมเลกุล
n = เลขเป็นจำนวนเต็มบวก เช่น 1, 2, 3
การปัดจุดทศนิยมของค่า n ตั้งแต่ 0.5 ขึ้นไป ให้ปัดขึ้นอีกหนึ่ง แต่ถ้าต่ำกว่า 0.5 ก็ปัดทิ้งไป เช่น 3.6
ก็ให้ปัดจุดทศนิยมเป็น4.0 และ 2.2 ปัดจุดทศนิยมเป็น 2.0
การหาสูตรโมเลกุลของก๊าซ และการหาร้อยละโดยมวลของธาตุจากสูตรเคมี
การหาสูตรโมเลกุลของก๊าซ มีหลักการดังนี้
1. สารทุกชนิดที่เกี่ยวข้องในปฏิกิริยาเป็นก๊าซหมด และสารที่จะหาสูตรโมเลกุลจะต้องเป็นก๊าซหรือไอเท่านั้น
2. สมมติสูตรโมเลกุลของก๊าซที่จะหาสูตรโดยทราบว่าประกอบด้วยธาตุใดบ้าง
3. ต้องทราบปริมาตรของก๊าซต่าง ๆ ที่เกี่ยวข้องกันในปฏิกิริยา และปริมาตรของก๊าซต้องวัดที่อุณหภูมิและความดันเดียวกัน
4. หาอัตราส่วนโดยปริมาตรก๊าซต่าง ๆ เป็นอย่างต่ำ
5. เปลี่ยนอัตราส่วนโดยปริมาตรของก๊าซเป็นอัตราส่วนโดยโมล โดยใช้กฎอาโวกาโดร
6. เขียนสมการของปฏิกิริยาเคมีตามโจทย์บอก แล้วเข้าสมการพีชคณิตของจำนวนอะตอมทั้งหมด ทางซ้ายและทางขวาของแต่ละธาตุให้เท่ากัน จะได้สมการพีชคณิตหลายสมการที่มีตัวแปรหลายตัว
จากนั้นก็คำนวณหาสูตรโมเลกุลของก๊าซได้
การหาร้อยละโดยมวลของธาตุจากสูตรเคมี
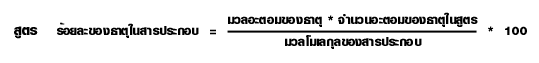
ความสัมพันธ์ระหว่างปริมาณของสารในสมการเคมี
สำหรับปฏิกิริยาที่เป็นก๊าซล้วน ๆ สามารถใช้สัมประสิทธิ์ของก๊าซต่าง ๆ ในสมการ มาอ่านเป็นปริมาตรได้ แต่ต้องที่อุณหภูมิและความดันเดียวกัน
N2(g) + 3H2(g) ------> 2NH3(g) ที่อุณหภูมิ และความดันเดียวกันปริมาตร (หน่วยปริมาตร) 1 3 2
การคำนวณเกี่ยวกับสมการเคมี มีหลักทั่วไปดังนี้
1. ต้องทราบสมการของปฏิกิริยาเคมีพร้อมดุล
2. พิจารณาเฉพาะสารที่โจทย์ถาม และกำหนดให้
3.แล้วนำสิ่งที่โจทย์กำหนดให้มาคิดคำนวณหาสิ่งที่ต้องการจากสมการได้โดยการเทียบบัญญัติไตรยางค์ ด้วยการใช้ความรู้เรื่องโมลหรืออาจจะคำนวณด้วยวิธีหนึ่งโดยนำจำนวนโมลของสารที่โจทย์ถามและโจทย์กำหนดให้มาเทียบอัตราส่วนกันจะเท่ากับจำนวนโมลที่เป็นสัมประสิทธิ์ของสารที่โจทย์ถามและโจทย์กำหนดให้ตามสมการ
สารกำหนดปริมาณ (Limiting Reagent) และร้อยละของผลได้ของสารผลิตภัณฑ์
สารกำหนดปริมาณ (Limiting Reagent)
สารที่เข้าทำปฏิกิริยามีปริมาณไม่พอดีกัน ปฏิกิริยาที่เกิดขึ้นจะสิ้นสุดเมื่อสารใดสารหนึ่งหมดสาร
ที่หมดก่อนจะเป็นตัวกำหนดปริมาณของผลิตภัณฑ์ของสารผลิตภัณฑ์ที่เกิดขึ้นเรียกว่าสารกำหนดปริมาณ (Limiting Reagent)
สารกำหนดปริมาณในการเกิดปฏิกิริยาเป็นการคำนวณสารจากสมการของปฏิกิริยาที่โจทย์บอกข้อมูลเกี่ยวกับสารตั้งต้นมาให้มากกว่าหนึ่งชนิด ลักษณะโจทย์มี 2 แบบ คือ
1. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด แต่ไม่บอกข้อมูลเกี่ยวกับสารผลิตภัณฑ์
ในการคำนวณต้องพิจารณาว่าสารใดถูกใช้ทำปฏิกิริยาหมด แล้วจึงใช้สารนั้นเป็นหลักในการคำนวณสิ่งที่ต้องการจากสมการได้
2. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด และบอกข้อมูลของสารผลิตภัณฑ์ชนิด
ใดชนิดหนึ่งมาให้ด้วย
ในการคำนวณให้ใช้ข้อมูลจากสารผลิตภัณฑ์เป็นเกณฑ์ในการเทียบหาสิ่งที่ต้องการจากสมการเคมี
ร้อยละของผลได้ของสารผลิตภัณฑ์
ในการคำนวณหาปริมาณของผลิตภัณฑ์จากสมการเคมีนั้น ค่าที่ได้เรียกว่า ผลได้ตามทฤษฎี
(Theoretical yield) แต่ในทางปฏิบัติจะได้ผลิตภัณฑ์น้อยกว่าตามทฤษฎี แต่จะได้มากหรือน้อยแค่ไหน ก็ขึ้นอยู่กับวิธีการและสารเคมีที่ใช้ เรียกผลที่ได้ว่านี้ ผลได้จริง (Actual yield)
สำหรับการรายงานผล การทดลองนั้น จะเปรียบเทียบค่าที่ได้ตามทฤษฎีในรูปร้อยละ
ซึ่งจะได้ความสัมพันธ์ดังนี้