ปริมาณสารสัมพันธ์ 1
มวลอะตอม
เนื่องจากอะตอมของแต่ละธาตุมีมวลน้อยมาก เช่น อะตอมของไฮโดรเจนมีมวล 1.66 * 10-24 กรัม
อะตอมของออกซิเจนมีมวล2.65 * 10-23 กรัม ทำให้ไม่สามารถชั่งมวลของธาตุ 1 อะตอมได้โดยตรง
ดอลตันจึงได้พยายามหามวลอะตอมของแต่ละธาตุโดยใช้วิธีการเปรียบเทียบว่าอะตอมาตุชนิดหนึ่งมีมวลเป็นกี่ท่าของอะตอมของอีกธาตุหนึ่งที่กำหนดให้เป็นมาตรฐาน
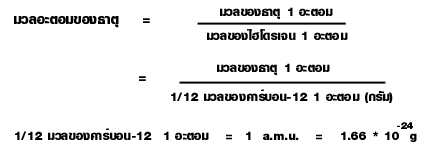
ดอลตันได้พบว่าไฮโดรเจนเป็นธาตุที่อะตอมมีมวลน้อยที่สุด จึงเสนอให้ใช้ไฮโดรเจนเป็นธาตุมาตรฐานในการเปรียบเทียบเพื่อหามวลอะตอมของธาตุอื่นๆโดยกำหนดให้ไฮโดรเจน 1 อะตอมมีมวลเป็น 1 หน่วย ด้วยวิธีการเช่นนี้ อะตอมของคาร์บอนมีมวลเป็น 12 เท่าของไฮโดรเจนก็จะมีมวลเป็น12 หน่วย อะตอมของออกซิเจนมีมวลเป็น 16 เท่าของไฮโดรเจนก็จะมีมวลเป็น 16 หน่วย ตัวเลขที่ได้จากการเปรียบเทียบมวลของธาตุ 1 อะตอมกับมวลของธาตุมาตรฐาน 1 อะตอม เรียกว่า มวลอะตอมของธาตุ
ต่อมานักวิทยาศาสตร์จึงได้ตกลงใช้คาร์บอน-12 ซึ่งเป็นไอโซโทปหนึ่งของคาร์บอนเป็นมาตรฐานในการเปรียบเทียบมวล เนื่องจากธาตุคาร์บอนสามารถทำปฏิกิริยากับธาตุอื่นๆ เกิดเป็นสารประกอบได้เป็นจำนวนมาก และคาร์บอน-12 เป็นไอโซโทปที่มีปริมาณสูงกว่าไอโซโทปอื่นๆ ของคาร์บอนอีกด้วย โดยกำหนดให้คาร์บอน-12 จำนวน 1 อะตอมมีมวล 12 หน่วยมวลอะตอม ดังนั้น 1 หน่วยมวลอะตอมจึงมีค่าเท่ากับ 1/12 มวลของคาร์บอน-12 จำนวน 1 อะตอมหรือเท่ากับ1.66 * 10-24 กรัม ค่าของมวลอะตอมของธาตุจึงเขียนเป็นความสัมพันธ์ไดดังนี้

ธาตุส่วนใหญ่ในธรรมชาติมีหลายไอโซโทป และแต่ละไอโซโทปมีปริมาณมากน้อยต่างกัน
มวลอะตอมของคาร์บอนที่คำนวณได้นี้เป็นค่ามวลอะตอมที่เฉลี่ยของคาร์บอนซึ่งสอดคล้องกับค่ามวลอะตอมของธาตุที่ปรากฏอยู่ในธรรมชาติ ดังนั้นค่ามวลอะตอมของธาตุใดๆ ในตารางธาตุจึงเป็นค่ามวลอะตอมเฉลี่ยซึ่งขึ้นอยู่กับค่ามวลอะตอมและปริมาณของแต่ละไอโซโทปที่พบอยู่ในธรรมชาติ
ปัจจุบันนี้นักวิทยาศาสตร์จึงหามวลอะตอมและปริมาณของไอโซโทปของแต่ละธาตุ โดยใช้เครื่องมือเรียกว่าแมสสเปกโตรมิเตอร์ ทำให้ได้ค่าที่แน่นอนและมีความถูกต้องสูง
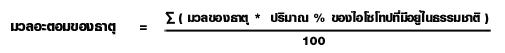
การหามวลอะตอมของธาตุ กรณีที่กำหนด%ไอโซโทปในธรรมชาติ
ตัวอย่างเช่น การคำนวณหามวลของ Li 3.01 x 1024 อะตอม จากข้อมูลต่อไปนี้
|
ไอโซโทป |
%ที่มีในธรรมชาติ |
มวลอะตอม |
|
3Li6 |
7.00 |
6.0200 |
|
3Li6 |
93.00 |
7.0100 |
การหามวลโมเลกุล
โมเลกุลของธาตุประกอบด้วยอะตอมของธาตุชนิดเดียวกัน เช่น โมเลกุลของก๊าซออกซิเจนประกอบด้วยธาตุออกซิเจน2 อะตอม ส่วนโมเลกุลของสารประกอบที่ประกอบด้วยอะตอมของธาตุต่างชนิดกันเช่น โมเลกุลของคาร์บอนไดออกไซด์ประกอบด้วยธาตุคาร์บอน1 อะตอมและธาตุออกซิเจน 2 อะตอม
ในกรณีที่ไม่ทราบชนิดและจำนวนอะตอมของธาตุที่เป็นองค์ประกอบในโมเลกุลของสาร แต่ทราบมวลเป็นกรัมของสาร1 โมเลกุล จะหามวลโมเลกุลของสารได้จากความสัมพันธ์ดังนี้

2. คิดจากผลบวกของอะตอมของธาตุต่าง ๆ ที่เป็นองค์ประกอบใน 1 โมเลกุลของสารนั้น
มวลโมเลกุล H2O = (2x1) 16 = 18
มวลโมเลกุล CuSO4*5H2O = 63.5 + 32 + (4x16) + (5x18) = 249.5
โมล
โมล เป็นหน่วยบอกจำนวนอนุภาคของสาร ซึ่งหมายถึงปริมาณของสารที่มีจำนวนอนุภาคเท่ากับจำนวนอะตอมของคาร์บอน-12ที่มีมวล 12 กรัม เราทราบแล้วว่าคาร์บอน-12 จำนวน 1 อะตอม มีมวล 12.00 * 1.66 * 10-24 กรัม
ดังนั้น เราสามารถคำนวณหาจำนวนอะตอมของคาร์บอน-12 ที่มีมวล 12 กรัมได้ โดยสมมุติให้คาร์บอน 12 กรัมมีจำนวนอนุภาคเท่ากับ a อะตอม เมื่อเขียนในรูปอัตราส่วนที่เท่ากับอัตราส่วนแรกจะเป็นดังนี้
แสดงว่าคาร์บอน-12 ที่มีมวล 12 กรัม ประกอบด้วยอะตอมของคาร์บอน 6.024096 * 1023 อะตอม จำนวน 6.02 * 1023 นี้เรียกว่า เลขอาโวกาโดร และกำหนดให้สารที่มีจำนวนอนุภาคเท่ากับเลขอาโวกาโดร คิดเป็นปริมาณ1 โมล ดังนั้น
สาร 1 โมลมี 6.02 * 1023 อนุภาค
สาร 2 โมลมี 2 * 6.02 * 1023 อนุภาค
สาร 0.5 โมลมี 0.5 * 6.02 * 1023 อนุภาค

การบอกปริมาณของสารเป็นโมล จะทำให้ทราบจำนวนอนุภาคของสารนั้นได้
ปริมาณของสารในหน่วยโมลมีความสัมพันธ์กับปริมาณอื่นๆดังนี้
ธาตุใดๆ ที่มีปริมาณ 6.02 * 1023 อะตอมหรือ 1 โมล จะมีมวลเป็นกรัมเท่ากับมวลอะตอมของธาตุนั้นๆ เช่น แมกนีเซียมมีมวลอะตอมเท่ากับ 24.3 ดังนั้นแมกนีเซียม 1 โมลหรือ 6.02 * 1023 อะตอมจะมีมวล 24.3
สารใดๆ 1 โมลหรือ 6.02 * 1023 โมเลกุลจะมีมวลเป็นกรัมเท่ากับมวลโมเลกุลของสารนั้น เช่น
คลอรีนมีมวลโมเลกุลเท่ากับ 71 ดั้งนั้นคลอรีน 1 โมลหรือ 6.02 * 1023 โมเลกุลจะมีมวล 32 กรัม
2. ปริมาตรต่อโมลของก๊าซ
ปริมาตรของก๊าซเปลี่ยนแปลงตามอุณหภูมิและความดัน การบอกปริมาตรของก๊าซจึงต้องระบุอุณหภูมิและความดันไว้ด้วย นักวิทยาศาสตร์กำหนดให้ อุณหภูมิ 25 องศาเซลเซียส และความดัน 1 บรรยากาศ เป็นภาวะมาตรฐาน (StandardTemperature and Pressure) และเรียกย่อว่า STP เช่นก๊าซออกซิเจน 32 กรัม (ปริมาณ 1 โมล) มีปริมาตรเท่ากับ22.4 ลูกบาศก์เดซิเมตรที่ STP หรือกล่าวอีกนัยหนึ่งว่าปริมาตรต่อโมลของก๊าซออกซิเจนมีค่า 22.4 ลูกบาศก์เดซิเมตรที่STP