| Zn2+ + 2e | ---> Zn | E0 = -0.76 |
| Fe2+ + 2e | ---> Fe | E0 = -0.44 |
| Cl2 + 2e | ---> 2Cl- | E0 = +1.36 |
| H2 + 2e | ---> 2H+ | E0 = 0.00 |
| Cu2+ + 2e | ---> Cu | E0 = +0.34 |
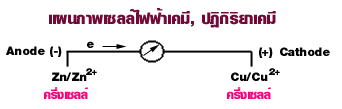
| ความ | =
ศักย์ = ศักย์ = Cu - Zn = +0.34 - (-0.76) = +1.10 Volts |
| ปฏิกิริยา | ครึ่ง ครึ่ง ทั้ง Zn + Cu2+ ---> Cu + Zn2+ |