โครงสร้างอะตอม
จอห์น ดอลตัน
เป็นคนแรกที่เสนอแนวคิดเกี่ยวกับอะตอม สรุปว่า
2. อะตอมของธาตุชนิดเดียวกัน จะมีมวลเท่ากัน มีสมบัติเหมือนกัน แต่จะแตกต่างจากอะตอมของธาตุอื่นๆ
3. อะตอมของธาตุสองชนิดอาจรวมตัวกันด้วยอัตราส่วนต่าง ๆ กัน เกิดเป็นสารประกอบได้หลายชนิด
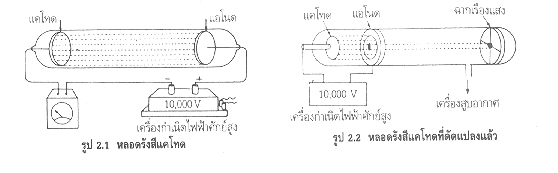
2.ทอมสัน ทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทดพบว่าไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้รังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสงเหมือนเดิม เมื่อคำนวณหาอัตราส่วนของประจุต่อมวล (e/m)ของอนุภาค จะได้ค่าคงที่ทุกครั้งเท่ากับ 1.76 x 108 คูลอมบ์ต่อกรัม สรุปว่า
อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า อิเล็กตรอน
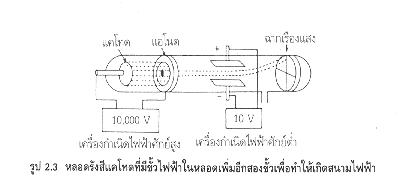
รูป 2.3 หลอดรังสีแคโทดที่มีขั้วไฟฟ้าในหลอดเพิ่มอีกสองขั้วเพื่อทำให้เกิดสนามไฟฟ้า
3.โกลดชไตน์ ดัดแปลงหลอดรังสีแคโทด เมื่อเปลี่ยนชนิดของก๊าซ พบว่าอนุภาคที่มีประจะบวกมีอัตราส่วนของประจุต่อมวลไม่คงที่ ถ้าใช้ก๊าซไฮโดรเจนจะได้อนุภาคบวกมีประจุเท่ากับประจุของอิเล็กตรอนจึงเรียกอนุภาคบวกว่า โปรตอน
4. มิลลิแกน ทำการทดลองหาค่าประจุของอิเล็กตรอน เท่ากับ 1.60 x 10-19 คูลอมบ์และเมื่อนำไปคำนวณหามวล ของอิเล็กตรอน จะได้เท่ากับ 9.11 x 10-28 กรัม
5. รัทเทอร์ฟอร์ด, ไกเกอร์ และมาร์สเดน ยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ พบว่า
อนุภาคส่วนใหญ่จะวิ่งเป็นเส้นตรงผ่านแผ่นทองคำ นาน ๆ ครั้งจะเบนไปจากแนวเส้นตรง
และน้อยครั้งมากที่อนุภาคจะสะท้อนกลับมากระทบฉากบริเวณหน้าแผ่นทองคำ
6. เลขอะตอม คือ ตัวเลขที่แสดงจำนวนโปรตอน
7. เลขมวล คือ ผลรวมของจำนวนโปรตอนและนิวตรอน
8. ไอโซโทป คือ อะตอมต่าง ๆ ของธาตุเดียวกันที่มีเลขมวลต่าง ๆ เช่น 11H, 21H และ 31H
9. สัญลักษณ์นิวเคลียร์
วิธีเขียน เลขอะตอมไว้มุมล่างซ้าย และเลขมวลไว้มุมบนซ้ายของสัญลักษณ์ เช่น 11Na23
10. การจัดอิเล็กตรอนในอะตอม
วิธีการใช้ในการหาข้อมูลเกี่ยวกับตำแหน่งของอิเล็กตรอนรอบนิวเคลียส คือการศึกษาสเปกตรัมของสารหรือธาตุแสงเป็นคลื่นแม่เหล็กไฟฟ้า แสงที่มองเห็นได้มีความยาวคลื่น 400 -700 นาโนเมตร แสงสีต่าง ๆ ในแถบสเปกตรัมของแสงได้แก่ ม่วง น้ำเงิน เขียว เหลือง ส้ม แดง
แสงสีม่วง มีความยาวคลื่นสั้นที่สุด แต่มีความถี่สูงที่สุด และมีพลังงานสูงสุด
แสงสีแดง มีความยาวคลื่นมากที่สุด แต่มีความถี่ต่ำที่สุด และมีพลังงานต่ำสุด
มักซ์ พลังค์ สรุปว่า พลังงานของคลื่นแม่เหล็กไฟฟ้าจะเป็นสัดส่วนโดยตรงกับความถี่ของคลื่นนั้น
E = h
E = พลังงาน จูล (J)
h = ค่าคงที่ของพลังค์ มีค่า 6.625 x 10-34 จูลวินาที (Js)
g
= ความถี่ของคลื่นแม่เหล็กไฟฟ้า (Hz)C = ความเร็วของคลื่นแม่เหล็กไฟฟ้าในสูญญากาศ = 3.0 x 108 m/s
l
= ความยาวคลื่น (m) (1 นาโนเมตร เท่ากับ 10-9 เมตร)พลังงาน
สเปกโตสโคป เป็นเครื่องมือสำหรับแยกสเปกตรัมของแสงขาวและตรวจเส้นสเปกตรัมของธาตุที่ถูกเผา การทดลองใช้ลวดนิโครมจุ่มลงในกรดไฮโดรลอริกเข้มข้น(HCI) แตะสารประกอบที่ต้องการทดสอบ นำไปเผาบนเปลวไฟ สังเกตสีของเปลวไฟและใช้สเปกโตสโคปสังเกตสีของเส้นสเปกตรัม
1. สีของเปลวไฟ หรือเส้นสเปกตรัม เกิดจากส่วนที่เป็นโลหะ (ion +) ในสารประกอบชนิดนั้น ๆ
2. ธาตุแต่ละชนิด มีเส้นสเปกตรัมเป็นลักษณะเฉพาะตัวไม่ซ้ำกัน
11.การศึกษาเรื่องสเปกตรัมของสารหรือของธาตุ สรุปได้ว่า
1. เมื่ออิเล็กตรอนได้รับพลังงาน จึงขึ้นไปอยู่ในระดับพลังงานที่สูงขึ้น ทำให้อะตอมไม่เสถียร
อิเล็กตรอนจึงคาย พลังงานเท่ากับพลังงานที่ได้รับเข้าไปพลังงานส่วนใหญ่ที่คายออกอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้า ปรากฎเป็นเส้น สเปกตรัม
2. การเปลี่ยนระดับพลังงานของอิเล็กตรอน อาจมีการเปลี่ยนข้ามขั้นได้
3. อิเล็กตรอนในระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียส
4. ระดับพลังงานต่ำอยู่ห่างกันมากกว่าระดับพลังงานสูง
ระดับพลังงานยิ่งสูงขึ้นจะยิ่งอยู่ชิดกันมากขึ้น
12. นีลส์ โบร์ สร้างแบบจำลองว่า อิเล็กตรอนในอะตอมวิ่งอยู่รอบนิวเคลียสเป็นชั้น ๆ
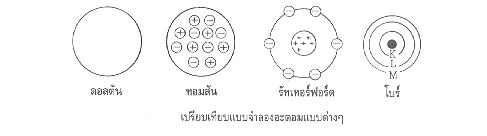
หรือเป็นระดับพลังงานมีค่าพลังงานเฉพาะคล้าย ๆ กับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ซึ่งแบบจำลองนี้ใช้ได้ดีกับอะตอมขนาดเล็กที่มีอิเล็กตรอนเดียว เช่น ไฮโดรเจนเท่านั้น
พลังงานไอออไนเซชันลำดับที่หนึ่ง ไม่ว่าจะเป็นของธาตุใดก็ตามล้วนมีค่าต่ำสุดเมื่อเทียบกับพลังงานไอออไนเซชัน ลำดับอื่น ๆ ของธาตุเดียวกันเพราะอิเล็กตรอนที่หลุดออกไปตัวแรกได้รับแรงดึงดูดจากนิวเคลียสน้อยที่สุด
14. จำนวนอิเล็กตรอนที่มีได้มากที่สุดในแต่ละระดับพลังงาน = 2n2
อิเล็กตรอนในระดับพลังงานสูงที่สุดของแต่ละธาตุ เรียกว่า เวเลนซ์อิเล็กตรอน
15. แบบจำลองอะตอมแบบกลุ่มหมอก สรุปได้ว่า
1. การเคลื่อนที่ของอิเล็กตรอนไม่มีทิศทางแน่นอน บอกได้เพียงโอกาสที่จะพบอิเล็กตรอน ณ
ตำแหน่งต่าง ๆ เท่านั้น
2. โอกาสที่จะพบอิเล็กตรอนในแต่ละระดับพลังงานไม่เหมือนกันขึ้นกับจำนวนอิเล็กตรอนและระดับพลังงานของ อิเล็กตรอนนั้น
3.อิเล็กตรอนที่มีพลังงานต่ำอยู่ในบริเวณใกล้นิวเคลียสมากกว่าอิเล็กตรอนที่มีพลังงานสูง